Q1
網膜再生医療はなぜ注目されているのでしょうか。



#4
株式会社VC Cell Therapy代表取締役
株式会社VC Gene Therapy代表取締役
株式会社ビジョンケア代表取締役社長
総合科学技術研究機構 教授
高橋 政代
2025 / 11 / 18
臨床研究で得られた成果を、確かに患者に届ける仕組みにどう変えるか。2014年、世界初のiPS細胞由来網膜細胞移植手術を成功させた高橋フェローは、その後10年を経て、医療の課題に正面から向き合っています。 市場性だけでは進めない治療開発。学会・制度・ファンドの仕組みを通じて、患者中心の医療システムを築く挑戦が続いています。 患者のための医療を実現するために、規制のあり方から社会実装まで、医療システムの本質的な改革に挑戦する高橋フェローの視点から、次世代医療の可能性を探ります。
SCROLL
about Masayo Takahashi
次世代の視覚再建
網膜変性疾患による視覚障害に苦しむ人たちに、失明の予防、さらにはもう一度光を取り戻す希望を提供することを目指しています。iPS細胞から網膜組織を作製し、患者網膜に移植する再生医療の発展に向けて、移植技術の改良だけでなく、治療後のリハビリテーションや新しい検査法など周辺技術の開発、さらには再生医療と共に新しい医療システムの構築に取り組んでいます。
1986年京都大学医学部卒業、1992年同大学大学院医学研究科修了。京都大学医学部附属病院、米国・ソーク生物学研究所研究員を経て、理化学研究所にて網膜再生医療研究を牽引。2014年世界初のiPS細胞由来網膜細胞移植手術を実施。2019年株式会社ビジョンケア代表取締役社長就任、遺伝子・細胞治療の子会社を設立。2025年国際幹細胞学会(ISSCR)「Public Service Award」受賞。








Q1 網膜再生医療はなぜ注目されているのでしょうか。
Q2 再生医療の治療開発において、どのような課題があるのでしょうか。
Q3 現在取り組んでいる医療改革について教えてください。
Q4 日本の医療システムを変革していくために、どのようなアプローチが必要でしょうか。
Q5 次世代の医療と社会に向けて、私たちはどう行動していけばよいでしょうか。



網膜変性疾患は、これまで「治らない病気」の代表格でした。WHO(世界保健機関)の2019年のレポートによると、全世界で少なくとも22億人が視覚障害を抱えており、そのうち少なくとも10億人は予防可能または白内障など治療可能な視覚障害とされていますが、逆に言うと残りは現代の医学で治療不可能な疾患です。
特に遺伝性の網膜疾患では、生まれた時から夜盲症があり、将来的な失明が運命づけられている患者さんも少なくありません。




そこに希望をもたらしたのが、iPS細胞技術の登場です。2012年の山中伸弥教授のノーベル賞受賞を機に、再生医療への期待は一気に高まりました。患者自身の細胞から作ったiPS細胞を網膜細胞に分化させ、それを移植することで視機能を回復させる。この画期的なアプローチが現実のものとなったのです。
2014年9月、私たちは世界初のiPS細胞由来網膜色素上皮細胞シート移植手術を実施しました。この成功により、再生医療は「夢の治療」から「現実の治療」へと変わりました。しかし、ここで重大な誤解が生まれることになります。



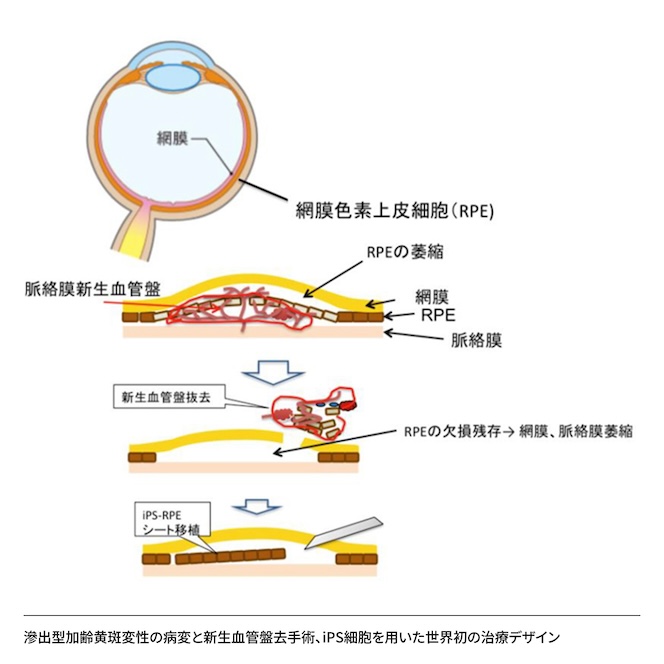

多くの人が期待する「治る」というのは、「すぐに視力が改善する」「見えるようになる」というイメージです。しかし、現在の網膜再生医療の真の価値は、「視力の維持」にあります。つまり、将来確実に失明すると分かっている患者さんが、一生見えたままでいられるという効果です。
これは患者さんにとっては非常に大きな意味を持つことです。遺伝性疾患で見えなくなることが決まっている人にとって、「これでもう大丈夫、見えなくならない」と言えることは、喜ばれる効果なのです。しかし、一般社会では「視力が上がらないなら意味がない」と受け取られがちで、この認識のギャップが様々な問題を引き起こしています。




例えば患者さんやご家族が「すぐに見えるようになる」という期待を持って治療を受けた場合、短期的な視力改善が見られないと「治療が失敗した」と感じてしまうことがあります。一方で、医師は「進行を止められた」ことを成功と捉えるため、双方の間に大きな溝が生まれてしまうのです。
また、報道においても、「画期的な治療法で視力回復」といった見出しが付けられることが多く、これが一般の人々の誤解を助長している面もあります。実際の治療効果よりも、センセーショナルな部分が強調されがちなのが現状です。
社会全体の理解を深めるためには、「予防医学」としての価値を広く啓発していくことが大切です。がん治療において「完治」だけでなく「進行抑制」や「延命」も重要な治療目標として認識されているように、眼科医療においても「視力維持」の価値を正しく評価する文化を育てていく必要があるでしょう。








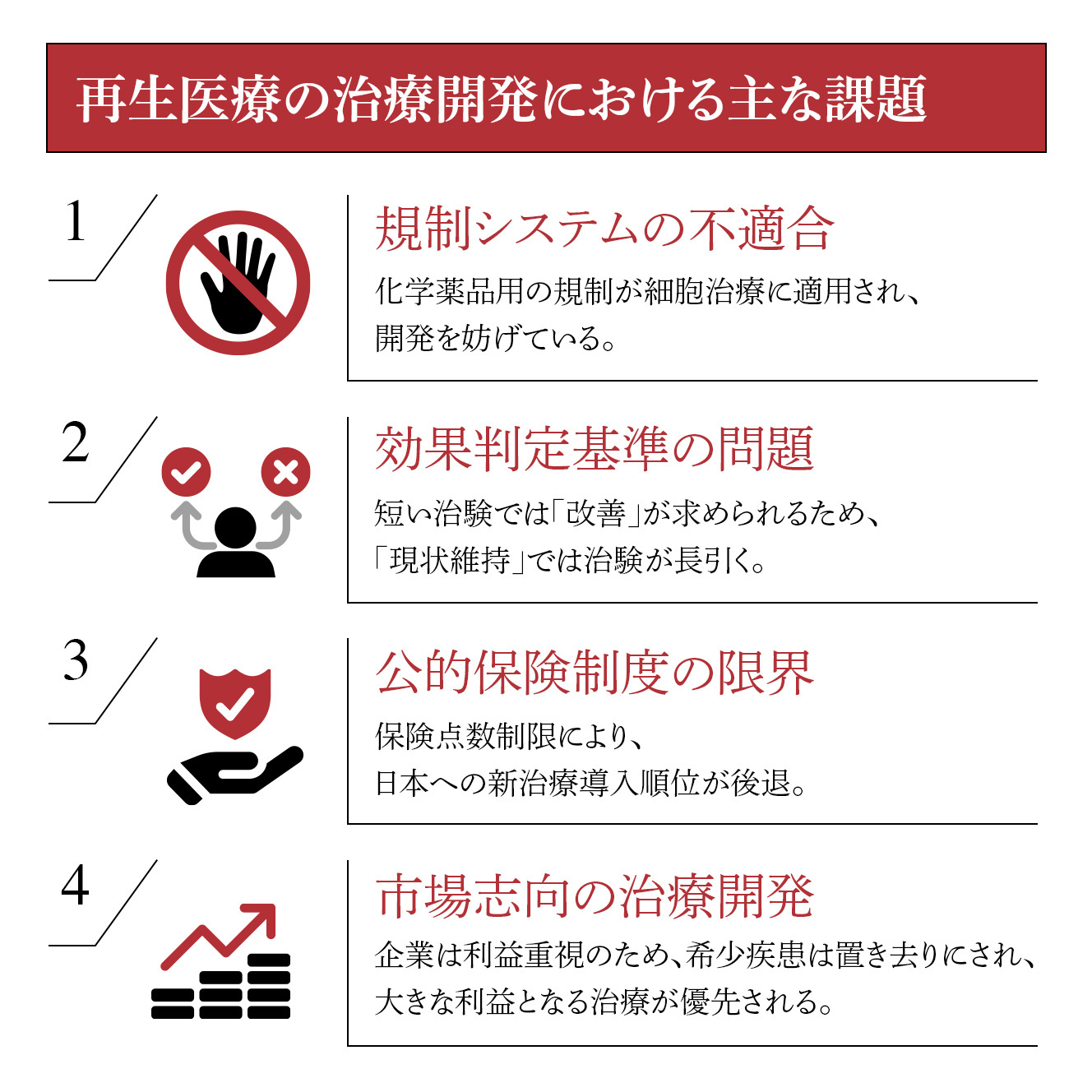
再生医療の治療開発で最も大きな課題は、既存の規制システムが細胞治療に適していないことです。現在の医薬品規制は、主に欧米の規制当局と製薬企業が化学物質である医薬品のために作り上げたルールが基盤となっています。
化学物質の薬は均一で変化しない物質ですが、異物でもあるため様々な安全性の確認が必要です。また、承認されれば何万人もの患者さんに投与されるので、工業製品として均一な製品である必要があります。
一方、細胞治療で使用する細胞は、もともと体内にあるものを培養して体内に戻すため、安全性に関しては細菌などの汚染がないかと腫瘍形成以外の副作用は化学物質ほどなく、少数例から始めるため当初は厳しい規制は必要ない場合があります。そのため、既存の薬用のルールを当てはめると、細胞治療の進化を妨げてしまう場合があるのです。




また、網膜治療の特殊性として効果判定の難しさがあります。具体例として、遺伝子治療の場合、失明が運命づけられた患者さんが遺伝子治療により一生見えるままでいられるという素晴らしい効果があるにも関わらず、規制当局は「視力向上」をエンドポイント(治験のゴール)に設定します。維持効果ではなく改善効果を求められるため、本来有効である治療が承認されないケースが発生しています。再生医療も同じことが起こります。




さらに日本特有の問題として、公的保険制度の限界があります。新しい治療を全て公的保険に組み込もうとすると、既存の医療予算を圧迫し、結果として「やってはいけない治療」が増えてしまいます。
現在、保険点数の制限により日本への新しい治療導入の優先順位は下がっており、昔はアメリカ、ヨーロッパに次いで新しい治療が導入される国だったのが、今では多くの国の後回しとなり、新しい治療がなかなか患者さんに届かない状況となっているのです。網膜の遺伝子治療の場合は世界で40か国目です。
この背景には、マーケットオリエンテッド(市場志向)な治療開発があります。企業は大きな利益が見込めない治療にはなかなか参画しにくい現状があります。そのため、世界的には関節などの再生医療が多く開発され、希少疾患は置き去りにされているのです。








私が取り組んでいる医療改革は、大きく2つの柱で構成されています。
日本は2014年、世界で初めて再生医療を包括的に規制する法律を制定しました。
それが 「再生医療等の安全性の確保等に関する法律」(再生医療安全性確保法)と、同時に改正された「医薬品医療機器等法」(薬機法、旧薬事法)です。




この2つの法律により、従来の企業主導の治験ルート(薬機法に基づく承認審査) に加えて、医師主導で再生医療等を提供するルート(再生医療安全性確保法) が制度的に位置付けられました。これにより、患者にとって有望と考えられる治療を、リスクに応じた安全管理体制の下で臨床提供できる仕組みが整えられたのです。
従来も「医師主導治験」や「先進医療制度」といった仕組みは存在していましたが、再生医療を対象に独立した法制度を設けた点が画期的でした。さらなる制度改革に向け、積極的に働きかけています。
その後、韓国は2019年に「先端再生バイオ法」を、台湾も2024年に「再生医療法」および「再生医療製剤条例」を制定しました。これらは日本の制度を参考にしたとされています。




改革の実践の場として、神戸アイセンターが2017年12月に開設されました。全国初の眼科専門のワンストップ型施設です。基礎研究から臨床応用、治療、さらにはロービジョンケア(視覚障害者の生活支援)までを一体的に提供する革新的な拠点です。




神戸アイセンターは、理化学研究所(設立時)、神戸市立神戸アイセンター病院、公益社団法人NEXT VISION、株式会社ビジョンケアの四者による連携体制によって運営されています 。内閣府の「総合知活用事例」第3回にも選出され、「視覚障害の課題解決に取り組むエコシステム」として評価を受けています 。



iPS細胞由来の網膜オルガノイドの世界初の臨床移植研究など、医師主導での再生医療の早期実用化にも取り組んでいます。ロービジョンケアを併せて提供する包括的な医療体制も特徴の一つです。








日本の医療システム変革には、以下のような多角的アプローチが考えられます。
日本の医療制度は、主に公的保険(社会保険・国民健康保険)が資金源となっており、補完的な民間保険は全医療費の約2%に過ぎません。民間保険を上手に活用・拡大することで、公的負担の軽減や医療の質・選択肢の拡大につながる可能性があります。
日本発の医療技術、特に再生医療などの先端的な分野をアジアに展開することで、産学官協働によるハブ形成の可能性があります。韓国や台湾も再生医療関連の法整備を進めているものの、日本と全く同じ体制ではありません。制度的多様性を踏まえた国際協力が鍵になります。



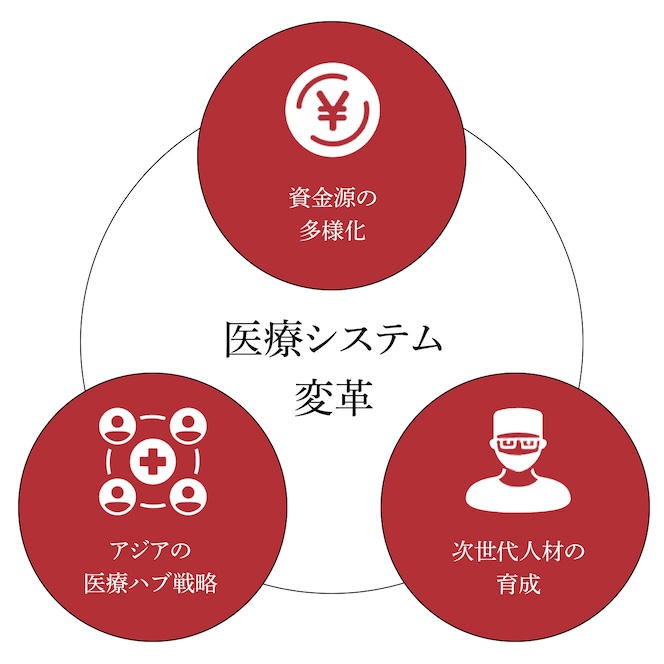
立命館大学をはじめ日本の産学連携により、再生医療分野で活躍できる博士・高度人材の育成が進められています。




RARAでは博士後期課程学生が自らの専門研究分野を深めるだけでなく、異なる分野の研究者などとの協働を通じてソーシャルインパクトを発揮することのできる「T型博士インパクトメーカー」を育成する「RARA 学生フェローシッププログラム」(RARA×SPRING)を推進しています。








研究は論文発表で終えるのではなく、社会実装まで見据えることも大切です。それにより一層価値が高まります。臨床現場では多忙さや研究費不足が課題となっていますが、近年はアカデミア発の臨床研究や先進医療制度を活用した治療開発も進んでいます。研究者自身が規制や産業化の仕組みを理解し、他分野と連携することで、研究の社会的価値がより明確になります。若手研究者は社会的な課題意識を高く持ち、その視野の広さを新しい挑戦につなげていきましょう。




制度は患者さんにとっての利益を最優先に設計されるべきだと考えています。規制は安全性を守るため不可欠ですが、科学技術の進歩に合わせた柔軟な更新も欠かせません。先進医療制度や臨床研究中核病院の仕組みを十分に活かすことで、治療開発のスピードと信頼性を両立させることができます。現在、アジア諸国との国際共同開発の可能性を探っており、再生医療に適したルール作りが重要になってきています。




医療の進歩を理解し、治療に対して適切な期待や認識を持つことが大切です。「効く」という言葉は必ずしも症状が改善することだけを意味せず、現状維持や進行抑制も大きな治療効果と言えます。治療を選ぶ際は、公的に承認された医薬品や、先進医療として評価されているものを参考にすることが安心につながります。残念ながら再生医療に関しては登録され厚労省ホームページに掲載されているクリニックもエビデンスのない治療を進めているところもあります。学会の公開資料などを活用し、信頼性のある情報源に基づいて判断してください。




医学や生命科学を学ぶ際には、専門知識に加えて社会との接点を意識することが必要です。医療は科学だけでは成り立たず、法律、経済、国際協力など多様な要素が組み合わさって実現します。異分野の人々と積極的に交流し、幅広い視点を取り入れることで、将来、実際に社会を変革する力を育むことができます。学際的な学びが大きな強みとなるでしょう。




最後に、iPS細胞による臨床研究が成功し、かつて不可能だった視機能の維持や回復が現実味を帯びてきた今、より重要なのは、科学的成果を真に患者さんのために活用できる社会制度や仕組みを築くことです。
iPS細胞がもたらした「科学が社会を変える力」を、今度は医療システム全体の変革に活かしていきます。再生医療は治療手段というだけではなく、患者中心の医療システムをつくるためのブレイクスルーのきっかけになる技術です。この技術を活かして、日本から世界に向けて新たな医療の在り方を発信していくことが、私たちの使命です。




この取り組みを支える仕組みの一つとして、立命館ソーシャルインパクトファンドから私が代表を務め、希少・難治性疾患を対象に遺伝子治療の実用化を目指すバイオベンチャー、株式会社VC Gene Therapyおよび網膜再生医療を開発する株式会社VC Cell Therapyへの投資が行われました。この支援は、再生医療や希少疾患の遺伝子治療という、市場の採算性だけでは推進しにくい領域においても、「患者オリエンテッドな治療開発」と持続可能なビジネスモデルの構築を目指すものです。



科学・制度・ビジネスが連携しながら進む道こそが、すべての患者さんに光を届ける未来をつくると信じて、これからも活動していきます。



