Newsletter / 研究活動レポート / 松村 浩由
RARA Newsletter vol.19(転載)世界が注目「分子界面制御」で挑む、地球規模の課題解決。松村浩由アソシエイトフェローに聞く、Nature Communications連続掲載の快挙
2025 / 10 / 21

2025 / 10 / 21
RARA Newsletter vol.19
世界が注目「分子界面制御」で挑む、地球規模の課題解決。松村浩由アソシエイトフェローに聞く、Nature Communications連続掲載の快挙
(2025年10月に登録者にメールでお届けしたNewsletterを転載したものです。Newsletterへの配信登録はこちらから)
秋の気配を感じる季節となりましたが、みなさまいかがお過ごしでしょうか。 立命館先進研究アカデミー(RARA)より、Newsletter vol.19をお届けいたします。
「次世代研究大学」を掲げる立命館大学では、さらなる研究高度化を牽引する制度として2021年にRARAを設立。大学の中核を担う研究者たちを「RARAフェロー」に、RARAフェローへのステップアップに向けて実績を積み重ねる研究者たちを「RARAアソシエイトフェロー」に任命し、研究活動と成果発信を進めています。
トップジャーナルへの連続掲載と「分子界面制御」という新領域への挑戦
今回のNewsletterでは、RARAアソシエイトフェローの松村浩由・生命科学部教授のインタビューをお届けします。

松村アソシエイトフェローは、国際的に高く評価されている学術誌『Nature Communications』(Springer Natureグループが発行する査読付きオープンアクセス誌)に2023年と2025年の短期間で2報の論文を発表・掲載されるという優れた研究成果を挙げています。
この快挙の背景にあるのが、松村アソシエイトフェローが取り組む「分子界面制御による生命機能科学」という新しい挑戦です。従来の生化学では、酵素やタンパク質の「活性部位」(化学反応を起こす中心部分)を改変することで機能の向上を図るのが主流でした。しかし松村アソシエイトフェローは、活性部位から離れた「分子界面」を操作することで、酵素の性能を向上させる可能性に気づき、機能改変や新機能の創出に取り組んでいます。
細菌の細胞分裂に関わるタンパク質の動的メカニズムを世界で初めて解明し、抗生物質が効かない薬剤耐性菌(MRSA等)などに対する全く新しいアプローチの治療薬開発にも取り組んでいます。
植物の光合成酵素の改良で、地球温暖化に挑む
また、現在注目されているのは、地球温暖化対策の一つの可能性を示す松村アソシエイトフェローの最新の研究成果です。植物の光合成に必須の二酸化炭素固定酵素「Rubisco(ルビスコ)」の活性を向上させたことで、モデル植物のシロイヌナズナの成長が約1.3倍も促進されることを見出しました。この発見は、植物の成長による気候変動対策と食料問題の同時解決につながる可能性を秘めています。
松村アソシエイトフェローの研究の原動力やテーマの選び方、研究哲学、学生との協働によるブレイクスルーの瞬間や成功の秘訣について聞きました。
(以下、松村アソシエイトフェローの話からライターが構成しました)
細菌の細胞分裂の謎を解く新発見
『Nature Communications』に掲載された2報の論文を簡単にご紹介します(詳しくは、Nat. Commun., 16, 5985 (2025); Nat. Commun., 14, 4073 (2023)を参照)。
細菌による感染症は、今もなお世界中で深刻な問題となっています。これまで、こうした感染症に対抗するためにさまざまな抗菌薬が開発されてきましたが、これらの薬に効かない「薬剤耐性菌」が現れたことで、新しいタイプの抗菌薬が必要とされています。その中で「FtsZ」というタンパク質は、多くの病原性細菌が持っていて、それらの細菌の増殖に欠かせないため、新しい薬のターゲットとして注目されています。
FtsZは数珠のように連なって細長いフィラメント状になって働くタンパク質で、これまでに多くの立体構造が「X線回折」によって明らかにされてきました。しかし、X線回折は結晶中のタンパク質の構造を見る方法です。結晶中ではタンパク質分子がぎゅうぎゅうに詰まっていて、細胞内を動き回るFtsZの構造を反映していない可能性が指摘されていました。よって結晶中ではなく、細胞内に近い環境である「溶液中」での構造解析が求められてきました。
そこで、大阪大学の難波啓一先生、藤田純三先生、笠井一希さんに共同研究を依頼して、溶液中のタンパク質を急速冷凍して電子線で観察する「クライオ電子顕微鏡」という方法を使うことにしてみました。しかし、FtsZはゆらぎの大きいタンパク質のため、クライオ電子顕微鏡を使ってその構造を調べるのは、世界中の研究者が挑戦してきたものの、何度も失敗してきました。私たち自身も、最初はうまくいかず、失敗の連続でした。
そこで、視点を変えて「人工抗体(人工的に作った標的タンパク質に結合する分子)」を用いてみました。私たちは、活性部位から離れた「分子界面」を操作する研究の一環として、酵素を改良する目的で人工抗体を酵素に結合させるといった研究を普段から行っていました。そのためFtsZに結合する人工抗体を比較的簡単に取得でき、その抗体をFtsZの「分子界面(タンパク質の表面)」に取り付けてみることができました。すると、不安定だったタンパク質の構造が、骨組みが入ったかのように安定し、これまでぼんやりとしか見えなかった部分が細かく観察できるようになったのです(図1)。

図1 FtsZのみの場合ぼんやりとしか見えなかった構造(左)が、人工抗体Mbを加えることで原子の位置までくっきり見ることができた(右)。
それまで見えなかったものがこんなにはっきり見えるというのは衝撃でした。初めに、FtsZに人工抗体を加えて見たときには(図1のFtsZ-Mbの負染色画像)、ちょうどウイルスの形に似ていたため、FtsZではないものが見えていると勘違いして、「これはコンタミ(コンタミネーションの略、ウイルスなど変なものが混じってしまったという意味)やろな・・・」と言ったほどでした。
ダメ元で構造解析してみたところ、この人工抗体を結合させることによって、FtsZフィラメントの曲がった構造を解析することができました。つづいて、こうした実験にヒントを得て、直線状になったFtsZフィラメント構造解析にも成功しました(図2)。細菌が細胞分裂するときにはFtsZは直線状のフィラメントから曲線状のフィラメントへと構造を変化させます(図3)。つまり、今回FtsZフィラメントの異なる状態、直線状態と曲線状態の両方の構造が初めてわかったため、「細菌が細胞分裂するときにFtsZフィラメントがどのように直線状から曲線状に変化するか」が明らかとなりました。

図2 直線状のFtsZフィラメント(左)と曲線状(らせん状)のFtsZフィラメント(右)
密集しながらも動き続ける巧妙なメカニズムを解明
細胞分裂は細胞膜を内側に凹ませる現象です(図3)。細胞膜を凹ませるためにはFtsZの働きだけでは不十分で、他のタンパク質が土台であるFtsZフィラメントに結合して、それらが協力して働く必要があります。2023年の成果は、その土台であるFtsZフィラメントのみを観察したものですので、実際の細胞分裂の仕組みの一部しか分からなかったことになります。そこで、今度はFtsZに結合してFtsZの働きを助けるタンパク質「ZapA」を組み合わせた研究を行いました。
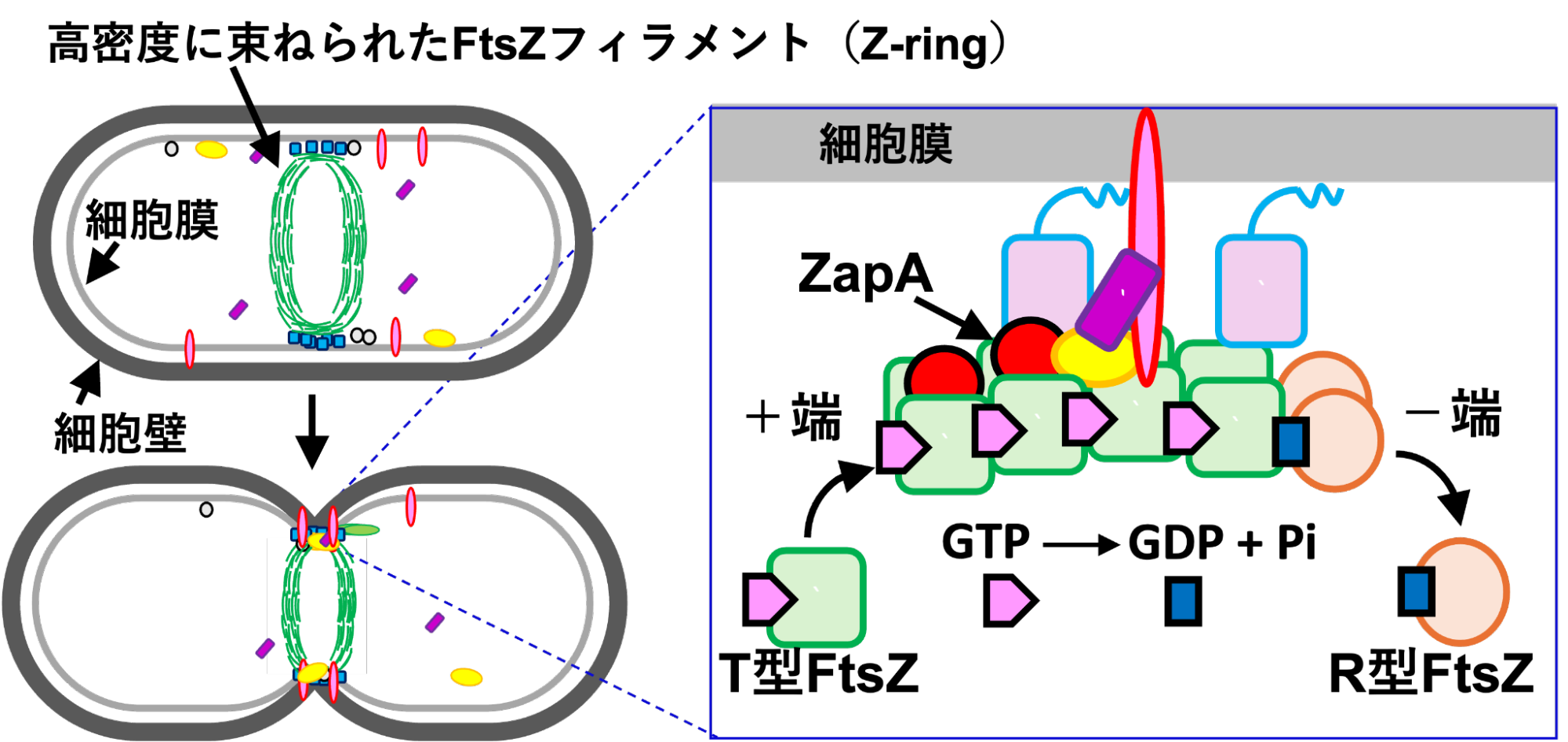
図3 細胞分裂の仕組み。数珠のように連なったフィラメント状のFtsZにZapAなどの他のタンパク質が結合し、FtsZと協力して細胞膜を内側に引っ張ると考えられている。
上で述べたように細菌が細胞分裂するときは、FtsZだけでなく他のタンパク質がFtsZに結合したりしながら協力して働きます。これらのタンパク質は密集しているのに常に動き回っていて、「なぜ互いにぶつからずに動けるのか」が大きな謎でした。
そこで私たちは、クライオ電子顕微鏡を使って、ZapAとFtsZが結合した複合体の構造解析に挑戦して、運良く約2.7Å分解能という極めて高い精度で観察することができました。その結果、ZapAが複数のFtsZに結合して、全体として「はしご」のような構造を形成していることが分かりました(図4)。
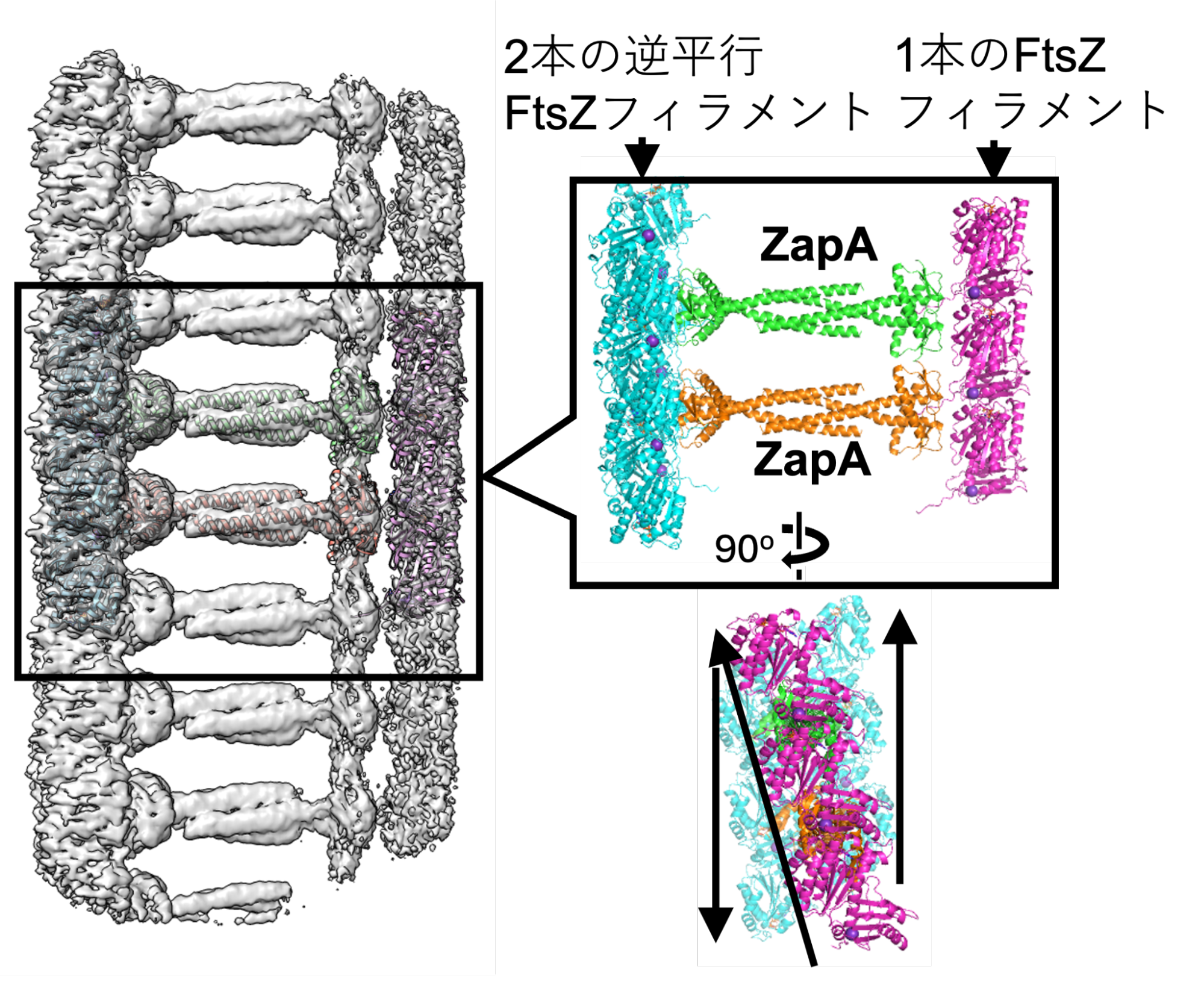
図4 FtsZフィラメントをZapAが束ねている様子。
興味深かったのは、束ねられたFtsZ同士の間では、マイナス電気同士の反発力が生じていることでした。この反発力があるおかげで、タンパク質が密集していても、お互いが自由に動くことができることがわかりました。
次に、名古屋大学の内橋貴之先生に共同研究を依頼して、高速AFMを使ってZapAがFtsZに結合していく様子をリアルタイムで観察しました。すると、ZapAの結合は静的なものではなく、短時間で結合と解離を活発に繰り返すというダイナミックなものだということが分かりました(詳しくは、朝日新聞デジタルを参照)。
つまり、細菌の細胞分裂では、タンパク質がまるで工事現場の足場のように組み立て直しを繰り返しながら、全体としては機能を維持しているという仕組みがあったのです。
国際的反響
『Nature Communications』などのトップジャーナルに掲載されることは、研究者としてトップレベルの土台に立つことだと思います。やはり論文の採択が決まったときは嬉しかったです。
ただし、この道のりは決して簡単なものではありませんでした。実際には、上で紹介した2報の論文ともに、掲載までに1年近くかかっています。それは、複数の査読者(論文をブラインドで評価する研究者)から論文の内容について様々な指摘を受け、その一つ一つに適切に返答をする必要があるからです。万が一、査読者の1名でもこちらの返答が不十分と感じられた場合には、掲載が取りやめになることもしばしばです。薄氷を踏む思いで、追加の実験を繰り返すことで、ようやく全ての査読者を納得させることができました。
反響としては、日本国内だけでなく、海外からの反響が大きいように感じています。2023年の発表のとき、著名な先生から「Congratulations!」とメールをもらいましたが、まだまだだと思っていました。
2025年にも同誌に発表できたとき、たくさん祝福のメールをいただいたり、海外の有名な先生から共同研究しようというオファーもいただいたりして、やはり論文で発表するというのは大事だと感じました。ようやく世界のトップレベルの端っこにちょっとだけ立てたという感覚です。
「分子界面制御」活性部位以外への新しいアプローチ
これら2報の論文に共通するのは、「分子界面制御」というアプローチです。
従来は、タンパク質の「活性部位(化学反応を起こす中心部分)」を直接改変するのが常識でした。
しかし私たちは、活性部位から離れた「分子界面」を改変したり、人工的な分子を付け加えたりすることで、タンパク質全体の機能を変えられるのではないかという思いをもって研究を続けています。
この「分子界面制御」のアプローチを考えたきっかけは、神戸大学の深山浩先生との共同研究で、Rubisco(ルビスコ)というCO₂固定酵素の研究でした(図5)。Rubiscoは、光合成のカルビン回路でCO₂を有機物に固定する中心的な酵素です。その本体部品のRbcLと、それを支えて調整する助っ人のようなRbcSが8つずつ集まった大きな酵素です。
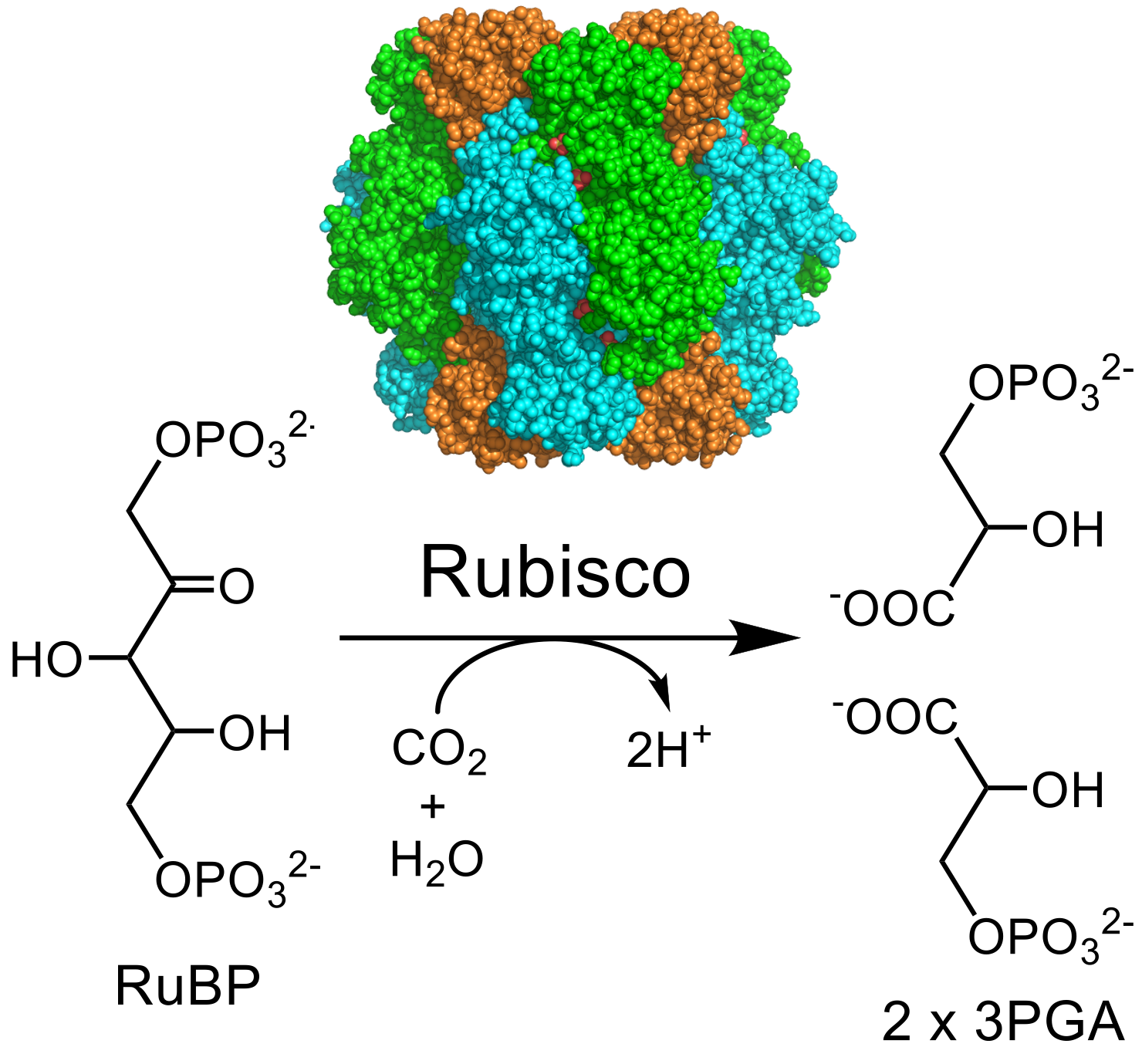
図5 Rubiscoの構造(上)と触媒する反応。Rubiscoは8つのRbcL(緑と水色)と8つのRbcs (オレンジ色)からなる。
酵素には化学反応を起こす部分である活性部位がありますが、RubiscoはRbcLに活性部位があるにもかかわらず、なぜかRbcSを交換するだけで、Rubiscoの活性が上昇しました(Mol. Plant, 13, 1570 (2020))。これは驚きでした。
これは、「頭が痛いときに足ツボを押すような感じ」かもしれません。従来は活性部位という「痛むところ」を直接刺激していましたが、私たちは離れた場所の「分子界面」という足ツボのようなところを刺激することで、酵素全体の働きを改善できる可能性に気づきました。
また、徳島大学の中澤慶久先生、大阪大学の梶浦裕之先生と共同で、バイオポリマーを作ることができるTPTという酵素は、ポリマーを作れないFPSという酵素ととても似ていますが、活性部位から離れた部分が変わっただけで、ポリマーが作れるようになっていることが分かりました(図6、Commun. Biol., 4, 215 (2021))。これも驚きでした。
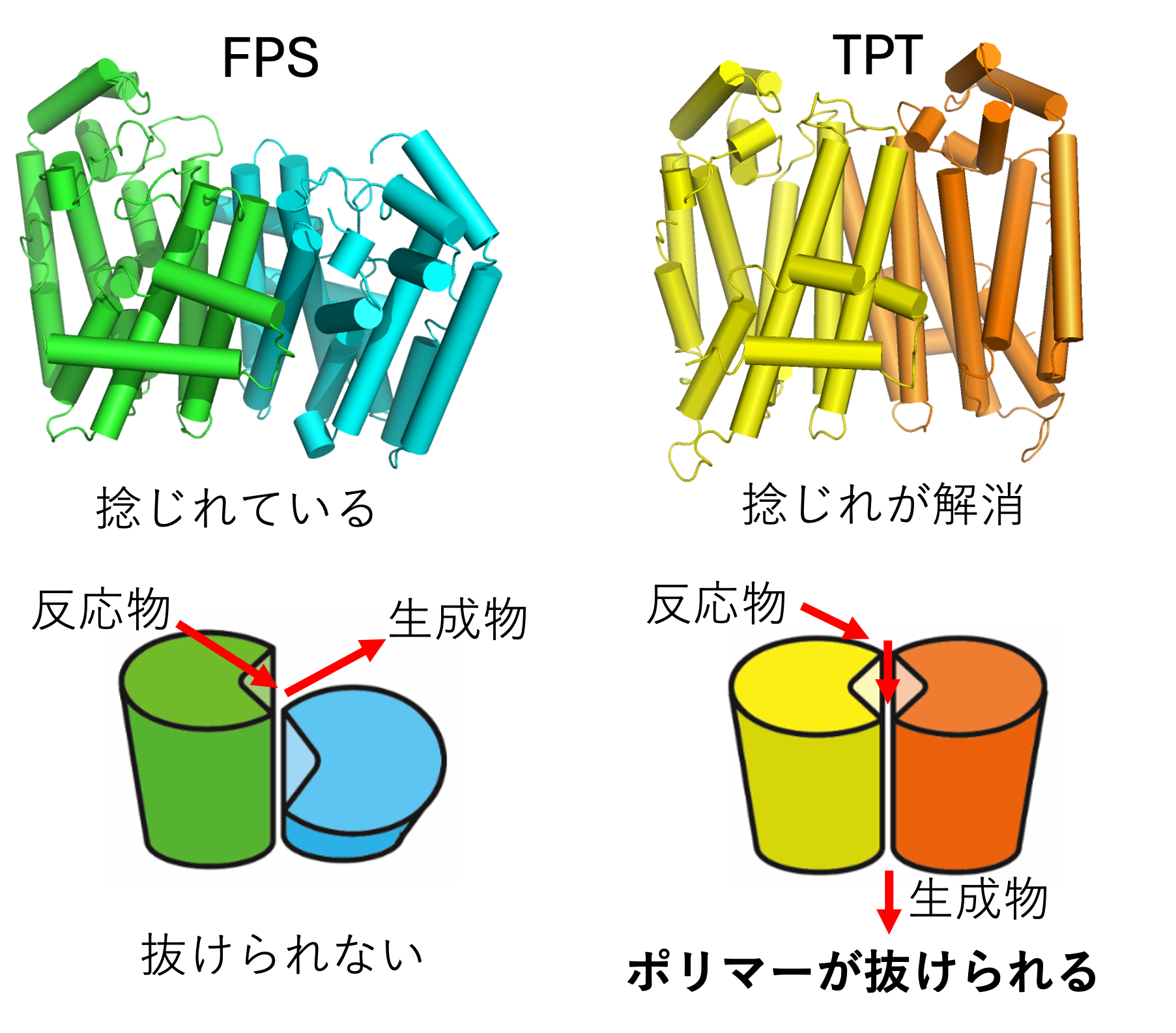
図6 ポリマーを作れないFPS(左)とポリマーを作るTPTの構造(右)。TPTは分子界面のアミノ酸が特徴的でその結果、分子の捻じれが解消してポリマーが抜けられるトンネルを作っていた。
これらがちょうど、2020年、2021年と連続で発表できたので、これは面白いと思いました。共通して「分子界面が変わることで機能が変わった」という研究でしたので、「分子界面制御」というキーワードで色々とやってみようと思ったのがきっかけです。
薬剤耐性菌問題への新たな治療法の開発も
私は大阪大学大学院時代からCO₂を固定する酵素を研究してきたのですが、2010年頃から何か自分独自のテーマを持ちたいと思い、先述した抗菌薬の標的でもある細菌の細胞分裂タンパク質FtsZに着目して研究を行ってきました。
腸内細菌や皮膚のバクテリア(細菌)など、細菌は私たちの身近にたくさんいます。目に見えないけれど一番多い生物が細菌で、地球上には10万種類以上いると言われています。私達が病気にかかってしまっている時には、悪さをする黄色ブドウ球菌や肺炎桿菌などの細菌が活発に分裂します。ということは、細菌の分裂を止める化合物が設計できれば、病気を治す薬となります。そのためにも細菌の分裂の仕組みを詳しく調べたいと思いました。
特に現在、従来の抗生物質が効かない「MRSA(メチシリン耐性黄色ブドウ球菌)」などの薬剤耐性菌が世界的な問題となっています。
私たちの研究は、細菌分裂の根本的なメカニズムを理解することで、全く新しい原理に基づく治療法の開発につながる可能性があると考えています。実際に、私たちはアメリカのラトガース大学のDaniel S. Pilch教授と共同で、2017年と2023年にFtsZに特異的に結合してMRSAの細胞分裂を抑制する化合物の開発にも成功しています(図7、ACS Chem. Biol., 12(7), 1947-1955 (2017); ACS Chem. Biol., 18, 629-642 (2023))。この化合物は従来とは異なる仕組みで働くため、細菌が新たな耐性を獲得しにくいという特徴があります。
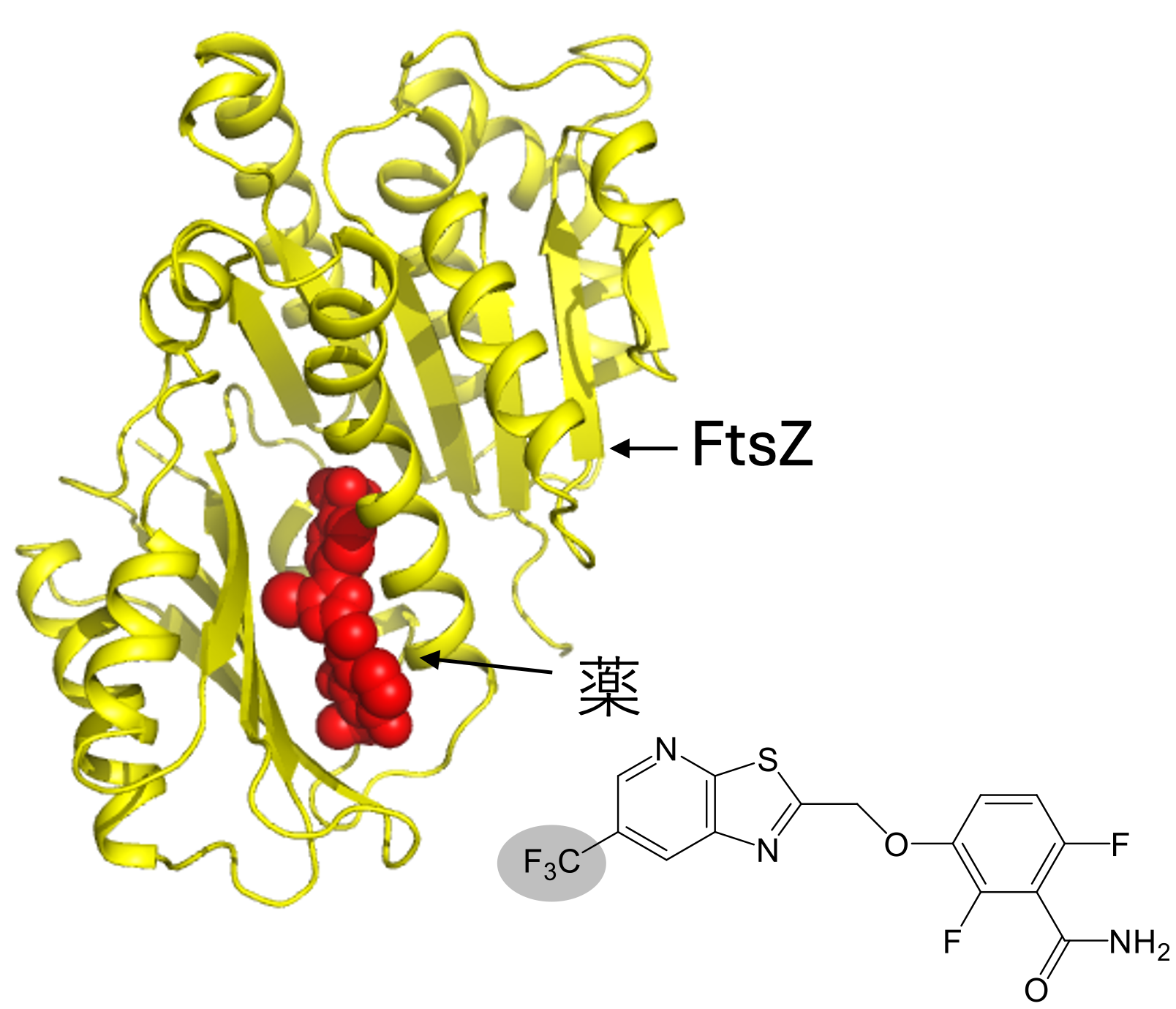
図7 FtsZに薬が結合している様子。構造解析によって、より強く結合する薬、つまりより効く薬が開発できる。
現在、さらに解析が進んでおり、副作用の少ない新しい医療技術の開発に貢献したいと考えています。
植物の光合成に関する発見──温暖化対策の可能性も
また今、少しワクワクしているのはRubiscoの研究です。
空気中のCO₂濃度は現在は約420 ppmに達しており(2025年)、これが気候変動の要因と考えられています。
植物は光を浴びてCO₂を吸収し酸素を出す光合成をします。現在、CO₂濃度が上昇している状況ですので、植物にとっては栄養が多いということになるので、本来はどんどん育つはずです。しかし、なぜか多くの植物の成長は頭打ちしています。そのリミッターを取っ払い、CO₂をどんどん食べられるようになれば、どんどん成長し、酸素に変えていってくれる──。そんな、地球温暖化対策につながるような研究成果が出てきています。
ジャーナルに投稿する前の論文であるプレプリントとしてすでにオープンな情報になっていますが(bioRxiv, 631008 (2025))、Rubiscoの活性部位から離れた分子界面を変えたことで、Rubiscoの活性が少し上がって、モデル植物であるシロイヌナズナが約1.3倍に成長したという結果が出ました。これは私が研究している間には無理と思っていたことで、これまでで一番驚きました。
今回、ほんの少しの酵素の改良(実際には1.1倍ほど触媒速度が上昇)ができたということが、植物の成長に大きなインパクトを与えるということが初めて分かりました。今後Rubiscoの触媒速度を1.2倍、1.3倍と改良できれば、より大きなインパクトになっていくかもしれません。他の植物でも試せる可能性があります。
無理だと言われていましたが、運よく結果が出たので、Rubiscoの研究を続けてきて良かったと思っています。
人と違うことをやり続ける意義
人と違うことをする、流行に乗らないというのも大事なことだと思っています。
実は、Rubiscoのテーマで2022年に日本結晶学会賞学術賞などもいただいていて、学術的には評価されてきたと思います。Rubiscoともう一つのCO₂を固定する酵素PEPCの研究を地道にやってきました。でも実用的には「役立たない」と思われていたと思います。
例えば、『Nature』にも以前、「Rubiscoの改良はできたけど、そのRubiscoを発現した植物がすごく小さくなった」という研究結果が掲載されていたので、多くの研究者が「Rubiscoを研究しても無駄なんじゃないか」と感じていたと思います。『Nature』は私たち研究者が一生で一報発表できればいいぐらいの超一流誌です。そこでこんな結果が発表されている訳ですから、私も正直、結果を出すのは厳しいと思っていました。
Rubiscoを改良して、「植物を改良できたら日の目を見るのに」という気持ちがある一方で、Rubisco研究に対する研究費はほとんど取れませんでしたし、半分諦めの気持ちになりかけながらも、細々と研究を続けてきました。
それが今回の結果でひっくり返ったのでびっくりしています。東京大学の有村慎一先生、中里一星先生らが新しいゲノム編集技術を開発して、同じく東京大学の矢守航先生とともに「この技術でRubiscoを変えてみよう。誰がRubisco研究やってるの?」という話になり、私に共同研究しようとたまたま声をかけてくださいました。そういったコラボレーションがうまくいったおかげです。
長年日の目を見なかった研究テーマでしたが、継続してきたからこそ、技術が追いついてきた時に活かすことができました。人と違うことをやり続ける大切さを、身をもって実感しています。
気候変動への危機感が研究の原動力
私の研究の原動力は、やはり気候変動への強い危機感です。私は自然が好きで休日は山に登ったりしていますが、ここ数年の夏の暑さは異常だと感じています。私達が住む地球はどうなっていくのでしょうか。
2050年には世界人口は97億人に達すると予測されており、さらなる温暖化の影響が懸念される地球上において、人類を支えるだけの食料とエネルギーをいかに持続的に供給していくか、温暖化によって蔓延する感染症をいかに抑えるかが、今後約半世紀の最大の難題です。私の研究は、こういった地球環境科学の重要課題解決への基盤を作ることを目標としています。
分子界面制御によって「新しい酵素、生物、薬、デバイス、技術」を作り、共同研究網を拡大し、大学外へ積極的に発信していきたいと考えています。
立命館への感謝、学生との協働が生んだ「セレンディピティ」
2015年に大阪大学から立命館に来て、2022年にRARAアソシエイトフェローに採択され、研究環境が大きく変わりました。恵まれている面が多いとも感じていますし、私もまだまだですが、徐々には成果を挙げつつあると思います。
セレンディピティというのは、その多くが偶然やミス、意図しないことから始まります。立命館の学生たちと協同する中で、セレンディピティを感じることが幾度もありました。
大阪大学時代、研究室で一緒に研究を進めてきた学生たちは、私の指示通りきっちりと実験をする印象でした。一方で私自身、実は予測が外れることも多く、私が提案することは間違いであることが多いという自覚があります。
立命館では、多様な個性を持つ(ときには「やんちゃ」な)学生たちとの協働が、思わぬ発見を生み出すことがありました。実際に、お互いのミスコミュニケーションや、学生の予想外の動きから生まれた意外な結果が、2021年のTPT研究の成功につながりました。それがきっかけでRARAアソシエイトフェローに採択されたので、不思議な感覚です。
ですから今、学生のみなさんには私が指示したことをやらなくでもOK、あるいは違うことをやってもらってもOKというスタンスで協働しています。もちろん、どうしても実験してほしいことはお願いしますが、実際に手を動かしている人の感覚が一番大事、それが私の基本スタンスです。
失敗を恐れない研究室文化に
学生のみなさんには、まずは堅実なテーマを設定して着実に結果を出して自信をつけてもらいつつ、挑戦的なテーマにも取り組んでもらっています。1人につきテーマは複数、3つ、4つぐらいまで並行して研究しているときもあります。時には挑戦的なテーマに挑んでことごとく成功する学生もいて、学生さんたちのポテンシャルに日々驚かされています(図8)。

図8 研究室メンバー
学生たちからは「また松村先生、変なこと言ってるわ」と見られることもあるように感じています。でも世界的な学術誌に論文が出て、学生も共著で出たりすることもあると、「あ、結構すごかったんや」と後で気づいてくれていることもあるようです。
最近は大学院進学をする学生が多く、今年指導している4回生は全員大学院へ進学して、私の研究室で研究を継続すると言ってくれています。私の研究への思いと学生たちのやる気がマッチしているのかもしれません。
国際協力の広がり──マレーシアとの学生交換プログラムも
RARAでの活動を通じて、国際的な研究協力も広がっています。特にマレーシアのマレーシアプトラ大学とは、私が20年前から指導してきた学生が現在教授として活躍していることがきっかけとなり、生命科学部の教職員の皆さんの協力のおかげで、年間約20人の学生交換プログラムが実現しています。
2019年にはマレーシアに2週間滞在し、タンパク質構造解析に関するワークショップやシンポジウムを開催しました(図9)。

図9 マレーシアプトラ大学でのワークショップ(上)とメンバーとのエクスカーション(下)
コロナ禍をきっかけにオンライン会議が普及したことで、国際共同研究のハードルも大きく下がり、世界中の研究者とのコラボレーションが身近になりました。
若手研究者へのメッセージ
読者の若手研究者のみなさんには、なかなか大変なことですが論文を書きつづけることを目指していただきたいと思っています。そしてその中でキラリと光る内容で、できればトップジャーナルにも挑戦してほしいと思います。やはりトップジャーナルに1報論文を発表できれば違う世界が見られますし、2報出せればさらに世界が広がると思います。リスクの高い基礎研究にトライさせてもらえるのは本学の強みだと思います。
ただ研究者は他人と違うことを追求する必要がありますので、孤独を感じるときもあります。それでもチャレンジはし続けないといけない。そのため、モチベーションの維持が難しいです。研究で成果が出ないときは、環境を言い訳にしたくなります。
そんな時でも、周りから刺激を受けられるように積極的にコミュニケーションをとったり、自分が無知なことを自覚して知らないことを聞きに行ったり、周囲の成長を支援して自分が周囲に相談できるようにするといった姿勢が大事だと思います。
長年続けてきた研究が、技術の進歩によって花開くこともあります。諦めずに継続することで、思わぬブレイクスルーが生まれる可能性があります。粘り強く共に頑張っていきましょう。
RARAでの活動と今後のビジョン
RARAアソシエイトフェローとして採用され、他分野の先生方とのコラボレーションの機会が増え、より学際的な研究を推進できるようになりました。世界人口の増加や温暖化の影響が懸念される中、人類を支えるための食料とエネルギーの持続的供給、感染症対策など、50年後の地球環境科学の重要課題解決への基盤作りが私たちの使命です。
分子界面制御によって「新しい酵素、生物、薬、デバイス、技術」を創出し、一般市民の生活に直結した分野への貢献を目指します。周りの環境に感謝しながら、引き続き挑戦的な研究を続けていきます。

(謝辞)
ここでご紹介した内容は、立命館大学生命科学部生物工学科構造生命科学研究室の上原了先生、岡本千恵さんをはじめ、学生の皆さんのご協力のもとに進めてまいりました。この場をお借りして、心より御礼申し上げます。
RARA Newsletterでは、RARAの最新情報やインタビューなどを月1回程度お届けしています。
RARA Newsletterへの登録はこちらから。
今後も様々な形でRARAやRARAフェロー・アソシエイトフェローの取り組みを発信していきます。
朝夕はめっきり涼しくなってまいりました。この秋の豊かな実りを祈っています。
また次回のNewsletterでお会いしましょう。RARA Newsletterに対するご意見・ご感想はこちらまで。


